新闻动态

新捷报,捷闻报 了解最新捷闻咨询
全球医械动态 | FDA医疗器械510(k) eSTAR正式实施

2023-10-20
原文网址:https://mp.weixin.qq.com/s/ObmPreGvJciAykLgPqCqCA

2023年10月2日,美国FDA正式公布了医疗器械510(k)电子提交模板的指南文件, 2023年10月1日为510(k)电子提交要求生效的日期。此次变动,将大大提高递交材料的质量以及FDA的审核效率。
eSTAR(Electronic Submission Template and Resource电子提交模板和资源):构建在结构化动态 PDF中的电子提交模板 16,可指导用户构建电子提交。eSTAR 是目前唯一可用于帮助将 510(k) 提交准备为电子提交的电子提交模板类型。为简单起见,使用此电子提交模板创建的电子提交通常称为 eSTAR。
而本次提交方式取代的是eCopy与eSubmitter。
eCopy:电子副本是以前要求的提交给FDA 的纸质副本提交的电子格式的重复设备提交。如下定义的,电子副本不被视为电子提交。
eSubmitter:免费提供的FDA 软件程序,包含电子提交模板,包括从 2018 年 9 月到 2021 年 5 月可用于准备510(k) 电子提交的 eSubmitter 电子提交模板,不再可用于准备 510(k) ) 提交。
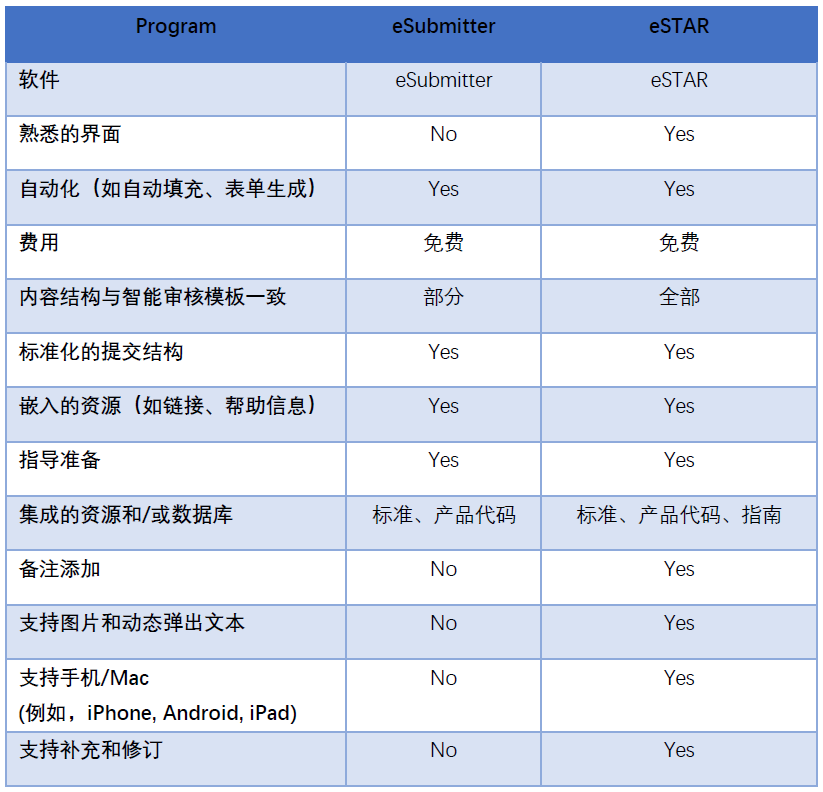
eSTAR与eSbumitter的区别:
那么新指南下 eSTAR提交时需要准备哪些资料呢?
需要准备的与之前大致相同。
- 系统需要提交产品描述、包装描述、标签、测试报告等等信息与数据。
- 如产品含有软件,需要准备软件文档;
- 如产品是无菌产品,需要准备灭菌相关的数据。由于系统由结构化数据和非结构化数据组成,部分信息已经转化成系统的结构化数据,与之前ecopy时代的文件的编排方式有所不同。建议在准备好基础资料之后就直接进行填写,按照eSTAR的框架结构来整合和编排数据。在填写的过程中可以进行保存和修订。
![]()
联系我们