新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻说丨ISO14155:2020 您需要了解的内容

2023-05-04
原文网址:https://mp.weixin.qq.com/s/otwd7cad7YrLC8fzRCt1Hw

临床研究在您将医疗器械推向市场的过程中发挥着重要作用。就制造商必须遵守的监管要求而言,这一过程通常被认为极其复杂,但对相关标准的深入理解有助于解决大多数问题。为此,做医疗器械的临床您应该熟悉ISO 14155:2020,以下是您在计划或将要开展临床研究之前需要了解的内容:
 ISO 14155是什么?
ISO 14155是什么?
ISO 14155:2020的全称是:人体用医疗器械的临床研究—临床试验质量管理规范,该标准是第三版,用于医疗器械临床研究的设计、实施、记录和报告。它为制造商和临床研究专业人员提供指导,指导他们如何在上市前和上市后临床研究中实施良好临床实践,以确定医疗器械的安全和有效。

ISO 14155标准规定了临床研究的通用规范和要求,以:
● 保护人类受试者的权益、安全和健康;
● 确保临床试验实施的科学性以及临床实验结果的可信度;
● 明确界定申办者和主要研究者的职责;
● 为参与医疗器械符合性评估的申办者、研究者、伦理委员会、监管机构以及其他相关机构提供协助。
除了ISO 14155,欧洲的临床研究还必须遵守欧盟医疗器械法规(MDR)。临床研究必须进一步遵守欧盟通用数据保护条例(GDPR).2016/679、赫尔辛基宣言和适用国家法律的相关规定。
 第三版(新版本)有什么新内容?
第三版(新版本)有什么新内容?
本标准的第三版引入了一些说明,以促进与其他国际标准(如ICH-GCP)的一致性。这些变化的主要目标是确保标准保持其全球接受水平。根据GCP进行临床研究不仅对在伦理条件下收集高质量数据很重要,而且对满足欧盟(EU)和美国(US)的法规的合规性也很重要。美国食品药品监督管理局(FDA)在遵循GCP的条件下,认可医疗器械试验的ISO14155标准 ,具体要求详见FDA指南《Acceptance of Clinical Data to Support Medical Device Applications and Submissions Frequently Asked Questions》
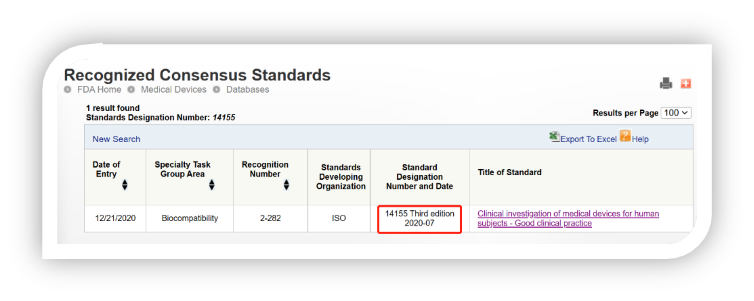
ISO 14155:2020最大的更新是强调了欧盟医疗器械法规(MDR)中提出的临床证据的作用,在临床研究的所有阶段应用ISO 14971风险管理原则,以及改进临床研究设计指南。ISO 14155的前一个版本仅在“研究器械风险”方面参考了ISO 14971,并支持风险-受益评估,以满足临床研究设计的基本原理要求。
2020年新版本将“临床风险管理”添加到发起人责任清单中,该列表引入了临床质量管理流程的概念,并要求发起人实施和监督,即使该任务外包给第三方临床研究组织(CRO)。
与上一个版本相比,新标准增加了25页(58页vs. 83页)。它共有十份附录(与第二版相比增加了三份附录);其中三个是规范性附录,包括要求。主要的变化包括:
● GCP原则的总结,与ICH-GCP一致;
● 临床研究在可公开访问的数据库[WS3] 中的注册
● 关于基于风险的监测和编写监测计划时的注意事项的指导;
● 关于统计因素的指导,符合公告机构日益增加的要求;
● 伦理委员会指南(新附录);
● 指导临床研究审核,符合临床质量管理;
● 在临床研究的整个过程中,根据ISO 14971加强风险管理;
● 临床研究计划中对特定医学专业知识的要求。
新版还澄清了GCP在不同临床开发阶段的适用性(早期可行性研究、上市前临床研究、上市后研究和注册)。在按照欧盟医疗器械法规(EU MDR 2017/745)的要求编写临床评估计划(CEP)的临床开发部分时,还是很有价值的。
 新标准的过渡期是?
新标准的过渡期是?
该标准自发布之日起(2020年7月)生效,无正式过渡期。它取代了ISO14155:2011版本。
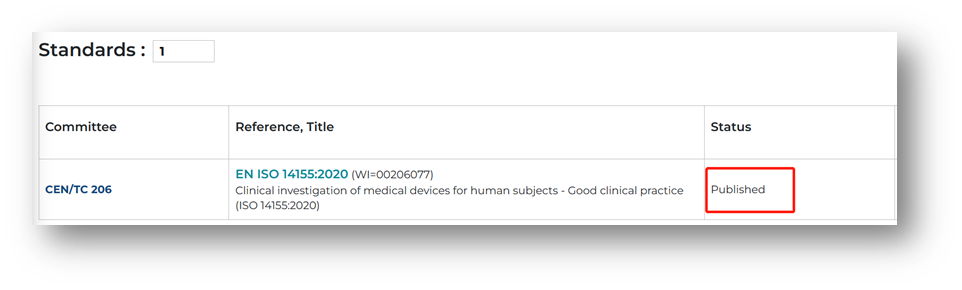
ISO 14155:2020与ICH E6(R2)相同吗?
ISO 14155:2020与ICH E6(R2)指南类似,但ISO 14155标准旨在为不同国家接受临床试验数据提供标准。ISO14155标准与ICH E6(R2)的不同之处在于它是专门针对医疗器械的临床。[WS4]
ISO 14155:2020与EN ISO14155:2020的内容相同吗?
ISO 14155:2020的文本已被CEN批准为EN ISO 14155:2020,发布的内容没有任何修改。

既然医疗器械的临床试验执行的ISO 14155:2020,那么各位看官们知道体外诊断医疗器械的临床试验执行什么标准吗?下期我们再聊聊体外诊断医疗器械依据的临床试验标准。
End
获取更多相关信息, 您也可以直接联系我们。
我们将竭诚为您服务!
![]()
联系我们