新闻动态

新捷报,捷闻报 了解最新捷闻咨询
重磅丨MDR过渡期延长靴子落地,制造商如何把握机遇?

2023-03-13
原文网址:https://mp.weixin.qq.com/s/l9mhyDSmNul3tat4qrTVQw

靴子落地,MDR过渡期再次延长在欧盟议会正式获得了通过。相比起原来2024年5月26日这个相当紧迫的时间节点,这次的延长期给得相当宽松。
基本上是按照风险越低,尺度越宽的原则。不同风险等级的产品延长期如下:
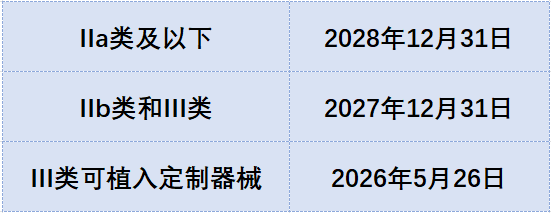
表一
对于之前还没有获得任何MDD证书的医疗器械企业,如果想在欧盟市场上市,咱们就直接按照MDR来申请好了,这个所谓的过渡期延长和咱们没关系。毕竟所谓过渡期,是指从
MDD指令监管到MDR法规监管的过渡,适用对象是已经获得MDD证书的企业。
以IIa类产品为例,从现在算起(2023年3月份)顺利延期的话,还有长达5年多的时间作为过渡。这段时间内获证产品可以在欧盟市场继续合法销售,对于企业来说肯定是个利好。

譬如,延期的条件概括起来是以下三点:
翻译成大白话就是:之前的产品在欧洲卖得很好,一直就没出过问题;制造商对产品的把控很好,后续的产品品质保持不变;有公告机构会继续承担监管责任。
在这三点中,和NB签署了书面协议至关重要,因为后续NB会签一份适当监督的确认函,这份确认函会和已有的证书一起构成证书依旧有效的书面凭证。
很容易看出,上述的1,2,3点就分别对应“风险可控,一致性强,责任明确”三原则。
![]() 如果MDD证书已经失效,也想延长该怎么办?
如果MDD证书已经失效,也想延长该怎么办?
如果MDD证书在此之前就过期了,那么就要按照MDR来做后续的申请,没有过渡期一说了。
如果在此之后过期,那么恭喜你,还有“证书复活”的机会,具体的做法如下:
![]() 为什么要向欧盟主管当局申请而不是向NB来申请呢?
为什么要向欧盟主管当局申请而不是向NB来申请呢?
这里面的原因还是可以用“责任明确”原则来解释,证书失效之后就已经脱离了NB的监管,NB对此也不承担责任了。所以制造商就要作为责任主体,通过欧代递交到监管当局来申请了。
目前业内把MDR延期这件事情各种条款和时间轴引用出来的很多,但是像捷闻这样能够基于自身多年的审核和辅导经验将这件事情掰碎了,并提炼出三原则用大白话讲清楚的并不多^_^。

Q MDD证书到期之后会有新证书吗?上面日期会显示已经过期了。
A 不需要新证书,旧证书和NB的确认函一起使用。
Q 我的MDD证书是A机构发的,现在我联系了B机构申请MDR,怎么延期?
A 建议咨询a和b机构,如何实施责任转换。
Q MDD证书上有3个产品,这次向NB申请了5个产品(包含了前3个产品),能不能把5个都延期?
A 已有的3个可以延期,新增的2个不可以。
Q 延期是向原NB申请好还是换一家更好?
A 建议继续向原NB申请,换NB理论上可行,但是实际操作起来并不简单。
Q 申请证书复活技术文档怎么准备,直接把原来的MDD文档递上去行不行?
A 按照MDR过渡期要求准备,一个需要注意的问题就是要看测试报告这些是否还有效,比如是否需要按照新版标准重
测? 建议向NB机构或者辅导机构老师咨询。
有更多的疑问,欢迎联系捷闻,
我们一起把握延期带来的机会!
End
![]()
联系我们








